Eş zamanlı hastalıkların tanımlanması, hastalıkların patofizyolojik mekanizmalarının tanınmasına yardımcı olur ve bu da yeni tedavi stratejilerinin geliştirilmesine yardımcı olur. Eşlik eden hastalıklar sıklıkla semptomların şiddetlenmesine ve hastalığın genel yükünün artmasına katkıda bulunarak yaşam kalitesini düşürür
Fibromiyalji (FM) ve uyku bozuklukları (UB) altta yatan tek bir kesin etiyolojinin olmadığı klinik tablolar olup eş zamanlı görülme olasılıkları da son derece yüksek tablolardır. Her bir klinik durumun nedenleri alt alta yazıldığında “stres” ortak kesişim kümesinde en çarpıcı şekilde yer alan faktör olarak karşımıza çıkar. Bu gözle bakıldığında tüm oklar hipoatalamus-hipofiz- adrenal aks (HPA aksı) üzerinde yoğunlaşmaktadır.
HPA aksı stres tepkisinin birincil düzenleyicisidir. Normal koşullar altında akut bir stres etkeni hipotalamusun paraventriküler çekirdeğine (PVN) kortikotropin salgılatıcı faktör (CRF) ve arginin vazopressini hipofiz portal venlerine salması için sinyal gönderir; bu da ön hipofiz bezinin adrenokortikotropik hormon (ACTH) salmasına neden olur. Dolaşımdaki ACTH, adrenal kortekse glukokortikoidleri (kortizol) salması için sinyal gönderir. İlk stres etkeninin kesilmesi üzerine CRF ve ACTH üretimini baskılayarak HPA aksının aktivasyonunu kapatmak için negatif feed-back döngüsü kurulur. HPA aksının düzenlenmesi kısmen HPA aksının her seviyesinde ve daha yüksek limbik bölgelerde bulunan glukokortikoid ve CRF reseptörleri tarafından yönetilir. CRF reseptörü 1 (CRF-1) ve 2 (CRF-2); CRF, CRF ilgili ligandları ve Ürokortin (Ucn) 1–3'e bağlanarak HPA aksinin düzenlenmesinde önemli bir rol oynayan G-proteine bağlı reseptörlerdir. Aktive edildikten sonra CRF-1 ve CRF-2, sırasıyla HPA fonksiyonunu artırmak ve azaltmak için birbirlerine zıt olarak çalışır. Glukokortikoid aracılı düzenleme, mineralokortikoid reseptörü (MR) ve glukokortikoid reseptörü (GR) olmak üzere iki reseptör aracılığıyla ve glukokortikoid aracılı retrograd endokannabinoid salınımı yoluyla gerçekleşir. Bu durum, pre-sinaptik terminallerden uyarıcı glutamaterjik moleküllerin salınımını baskılar ve daha sonra CRF'nin hipotalamik salınımını inhibe eder.
Hipokampüs, amigdala ve prefrontal korteks de dahil olmak üzere limbik yapılar, stresli bir olaydan sonra HPA aksinin yeniden ayarlanmasına yardımcı olur ve tonunu düzenlemeye yardımcı olur. Hipokampüs ve prefrontal korteksten gelen nöral projeksiyonlar çoğunlukla glutamaterjiktir ve PVN içindeki GABAerjik internöronlar üzerinde sinaps yapar, böylece HPA aksı aktivasyonunu azaltır Amigdala ise disinhibisyon yoluyla HPA aksını aktive ederek, GABAerjik projeksiyonları PVN'nin GABAerjik nöronlarına gönderir. Yapılan bir deneysel çalışmada amigdalaya doğrudan kortikosteron uygulanmasının amigdaladaki CRF ekspresyonunu artırdığı ve bunun visseral ve somatik aşırı duyarlılıkla örtüştüğünün gösterilmesi amigdalanın HPA aksını aktive ettiğinin bir göstergesi olarak düşünülmektedir. Özetle HPA aksınden gelen normal stres tepkilerini düzenlemede önemli rol oynayan ve sonuç olarak ağrı algısını etkileyen; limbik yapılardan gelen inhibisyon/aktivasyon arasındaki dengedir (2,3,4).
Mast hücreleri (MC'ler), innat bağışıklık sisteminin parçasıdır ve en büyük periferik CRF depolarından birini içerdikleri için HPA ekseninin aktivasyonuna oldukça duyarlıdırlar.
Çoğunlukla çevreyle doğrudan temas halinde olan bölgelerde olmak üzere, yüksek oranda vaskülarize dokularda bulunurlar: cilt, solunum yolu, gastrointestinal ve idrar yolları. Farklılaşmaları sitokinlerin ve büyüme faktörlerinin varlığına bağlıdır. MC, histamin, heparin, triptaz ve diğer proteazlar ve sitokinler içeren granüllerle doludur. CRF ve Substance P (SP) gibi endojen nöropeptitler dahil olmak üzere bağışıklık ve bağışıklık dışı sinyallerle aktive olurlar ve aşırı duyarlılık reaksiyonlarına neden olurlar. MC'ler vücuttaki miyelinsiz sinirlerin bitişiğinde, cilt ve dahil olmak üzere ve dura mater'deki sinir lifleriyle doğrudan temas halindedir. SP ve CGRP de dahil olmak üzere nöropeptitler salgılayarak periferik nörojenik inflamasyon da üretir ve sürdürürler, bu da yakın çevrede inflamatuar mediatör salınımını sürdürür. Bu nedenle, düzensiz HPA eksen aktivitesi nedeniyle artan periferik CRF salınımı MC aktivasyonuna ve buna bağlı olarak yakındaki duyusal sinir uçlarının hassaslaşmasına ve ağrı eşiklerinin düşmesine neden olabilir (Şekil 1). (5-8)
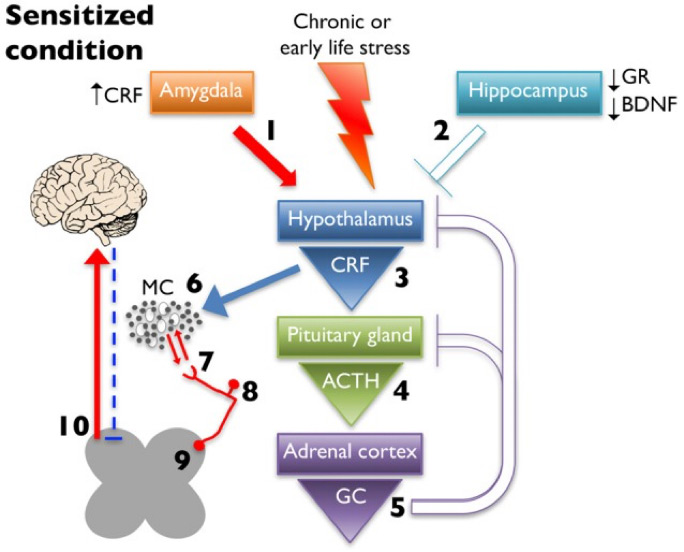
Şekil 1: Kronik erken yaşam veya yetişkinlik stresi, HPA ekseninin limbik regülasyonunda değişikliğe yol açar. Amigdalanın neden olduğu aktivasyon (1), hipokampüste glukokortikoid reseptörü (GR) ve BDNF ekspresyonunun azalmasından kaynaklanan inhibisyon(2) hipotalamustan artan CRF salınımına (3), stres etkeninin kesilmesinden sonra artan ve uzun süreli ACTH salınımına (4) ve daha yüksek yapılarda azalan negatif feed-back’le artan glukokortikoid (GC) üretimine (5) yol açar. Artan CRF salınımı daha fazla mast hücre (MC) aktivasyonuna ve infiltrasyonuna (6) bu da artmış periferik nosiseptör etkileşimine (7) yol açar. Artan periferik aktivasyon hiperaljeziye (8) ve/veya wind-up fenomenine (9) yol açar ve sonunda çıkan ağrı sinyallemesini artarken inen inhibisyon azalır (10). (Şekil referans 4’den alınmıştır)
Kısaca HPA aks mekanizmasının duyarlılığının artışının aktarılmaya çalışıldığı bu bilgilerle fibromiyalji hastalarının HPA aks bozukluğuna bağlı hem periferik duyarlılık artışı, hem inen ve çıkan yollardaki etkileri ve dolayısıyla santral sensitizasyondaki etkilerinin anlaşılması mümkündür.
Uykunun HPA aksı ile ilişkisi ise tamamen iki yönlüdür. HPA aks bozukluğu uykuyu bozarken, uykunun normal şartlarda gerçekleşmemesi de HPA aksını olumsuz etkiler.
Uyku ve stres arasındaki ilişki yüzlerce yıldır bilinmesine rağmen, uykunun çeşitli özellikleri ile stres sistemi aktivitesi arasındaki ilişkiye dair daha sistematik bir yaklaşım ancak son yirmi yılda ortaya çıkmıştır. Özellikle yavaş dalga uykusu (Uykunun 3. Evresi) HPA ekseni ve kortizol salgılanması üzerinde engelleyici bir etkiye sahiptir. Tersine CRH'nin ve glukokortikoidlerin sistemik uygulanması veya yüksek olması uyarılmaya ve uykusuzluğa yol açabilir. Normal bireylerde uyanıklık ve evre 1 uykusu (hafif uyku) kortizol artışlarına eşlik ederken, yavaş dalga uykusu veya derin uyku plazma kortizol seviyelerinin azalmasıyla ilişkilidir. Ek olarak, normal kişilerde, indüklenen uyku bozulması (sık tekrarlanan uyanmalar) plazma kortizol seviyelerinde önemli artışlarla ilişkilidir.
Bilinçsiz uyanıklığa benzeyen merkezi sinir sistemi aktivasyonu durumu olan REM uykusu miktarı (paradoksal uyku), HPA ekseninin daha yüksek aktivitesiyle ilişkili görünmektedir. Sağlıklı, normal uyuyanlar üzerinde yapılan bir çalışma, REM uykusu miktarının 24 saatlik idrar serbest kortizol atılımıyla pozitif korelasyon gösterdiğini göstermiştir. Bu sonuçlar HPA ekseni aktivasyonunun bir arada bulunmasıyla tutarlıdır ve melankolik depresyonu olan hastalarda REM uykusu artar (9). Şekil 2’de CRH, ACTH ve glukokortikoid ve sempatik sinir sisteminin uyku evrelerine olan etkileri şematize edilmiştir.
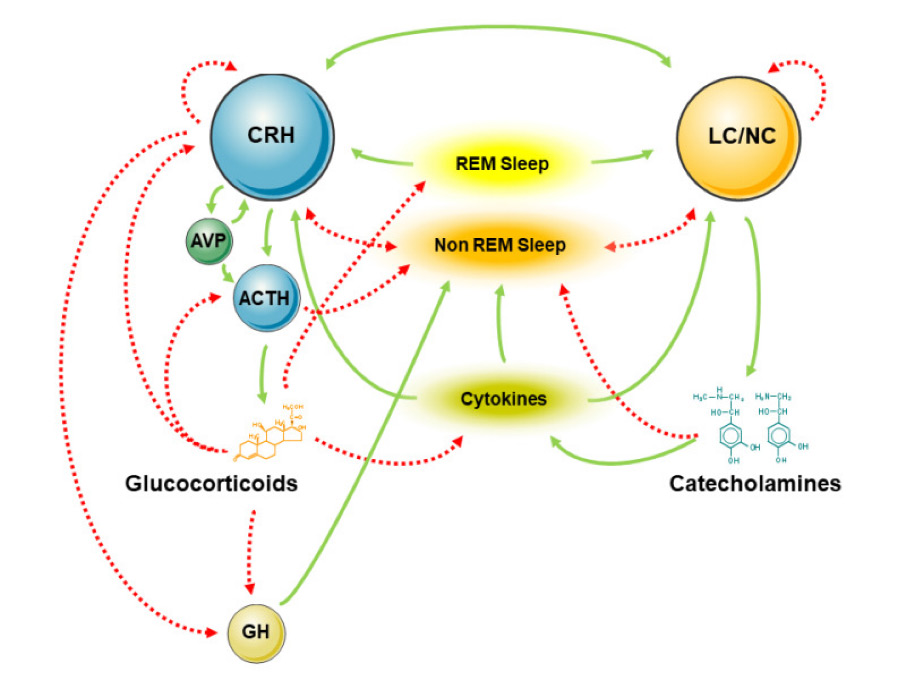
Şekil 2. Stres sistemlerinin merkezi ve çevresel bileşenleri ile uyku ve REM uykusu arasındaki etkileşimlerin basitleştirilmiş modeli. ACTH: kortikotropin; AVP: arginin vazopressin; CRH: kortikotropin salgılatıcı hormon; GH: büyüme hormonu; LC/NE: locus caeruleus norepinefrin/sempatik sinir sistemi. Kesintisiz yeşil çizgi teşvik/uyarımı; kesikli kırmızı çizgi baskılamayı gösterir. (Şekil referans 9’dan alınmıştır)
Bu veriler ışığında fibromiyalji hastaklarında hem ağrının hem de uykunun kontrolü için HPA aksının regüle edilmesinin önemi ortaya çıkmaktadır. Fibromiyalji ve uyku bozukluğu aynı kaynaklardan etkilenerek ortaya çıkan ortak klinik durumlar olarak kabul edilmelidir.
Hem ağrı hem de uyku bozukluğunun kontrol altına alınabilmesi için regülasyon tıbbından faydalanmak regülasyon tıbbının zaten mevcut çıkış noktasıdır. Nöralterapinin yanı sıra vücut ve kulak akupunkturu da destek olarak uygulanabilir.
Nöralterapide segment tedavileri, hormonal aks uygulamaları ki özellikle uyku bozukluklarında tiroidin değerlendirilerek tedaviye eklenmesi, genişletilmiş segment, ganglion ve gereğinde bozucu alan tedavisi her iki klinik durumun birlikte tedavisi açısından çok önemli tedavi uygulamalarıdır.
- Lee W, Shin HJ, Min IK, Kim CS, Kim KM, Heo K, Chu MK.
Shared comorbidity of depression, migraine, insomnia, and fibromyalgia in a population-based sample . J Affect Disord. 2024 Jun 1;354:619-626. - Herman J. P., Ostrander M. M., Mueller N. K., Figueiredo H. (2005). Limbic system mechanisms of stress regulation: hypothalamo-pituitary-adrenocortical axis. Prog. Neuropsychopharmacol. Biol. Psychiatry 2005;29:1201–1213.
- 2Ulrich-Lai Y. M., Herman J. P. Neural regulation of endocrine and autonomic stress responses. Nat. Rev. Neurosci. 2009;10:397–409.
- Eller-Smith O, Nicol AL, Christianson JA. Potential Mechanisms Underlying Centralized Pain and Emerging Therapeutic Interventions. Front Cell Neurosci 2018 13:12:35.,
- Hanna-Mitchell A. T., Wolf-Johnston A., Roppolo J. R., Buffington T. C., Birder L. A. Corticotropin-releasing factor family peptide signaling in feline bladder urothelial cells. J. Endocrinol. 2014;222:113–121.
- Buckley M. M., O’Halloran K. D., Rae M. G., Dinan T. G., O’Malley D. Modulation of enteric neurons by interleukin-6 and corticotropin-releasing factor contributes to visceral hypersensitivity and altered colonic motility in a rat model of irritable bowel syndrome. J. Physiol. 2014; 592, 5235–5250.
- Brierley S. M., Hughes P. A., Page A. J., Kwan K. Y., Martin C. M., O’Donnell T. A., et al. The ion channel TRPA1 is required for normal mechanosensation and is modulated by algesic stimuli. Gastroenterology 2009;137:2084
- Anand P., Singh B., Jaggi A. S., Singh N. Mast cells: an expanding pathophysiological role from allergy to other disorders. Naunyn Schmiedebergs. Arch. Pharmacol. 201:385, 657–670.
- Nicolaides NC, Vgontzas AN, Ilia Kritikou I. HPA Axis and Sleep. In: Endotext [Internet]. South Dartmouth (MA): MDText.com, Inc.; 2000.;2020 Nov 24. PMID: 25905298
Prof. Dr. Füsun Şahin
Fizik Tedavi ve Rehabilitasyon Uzmanı, Nöralterapist, Akupunkturist, Ozonterapist
Serbest Hekim, Denizli
@drfusunsahin, @fibromiyaljihekimi
